Última actualización: 16 de abril de 2021
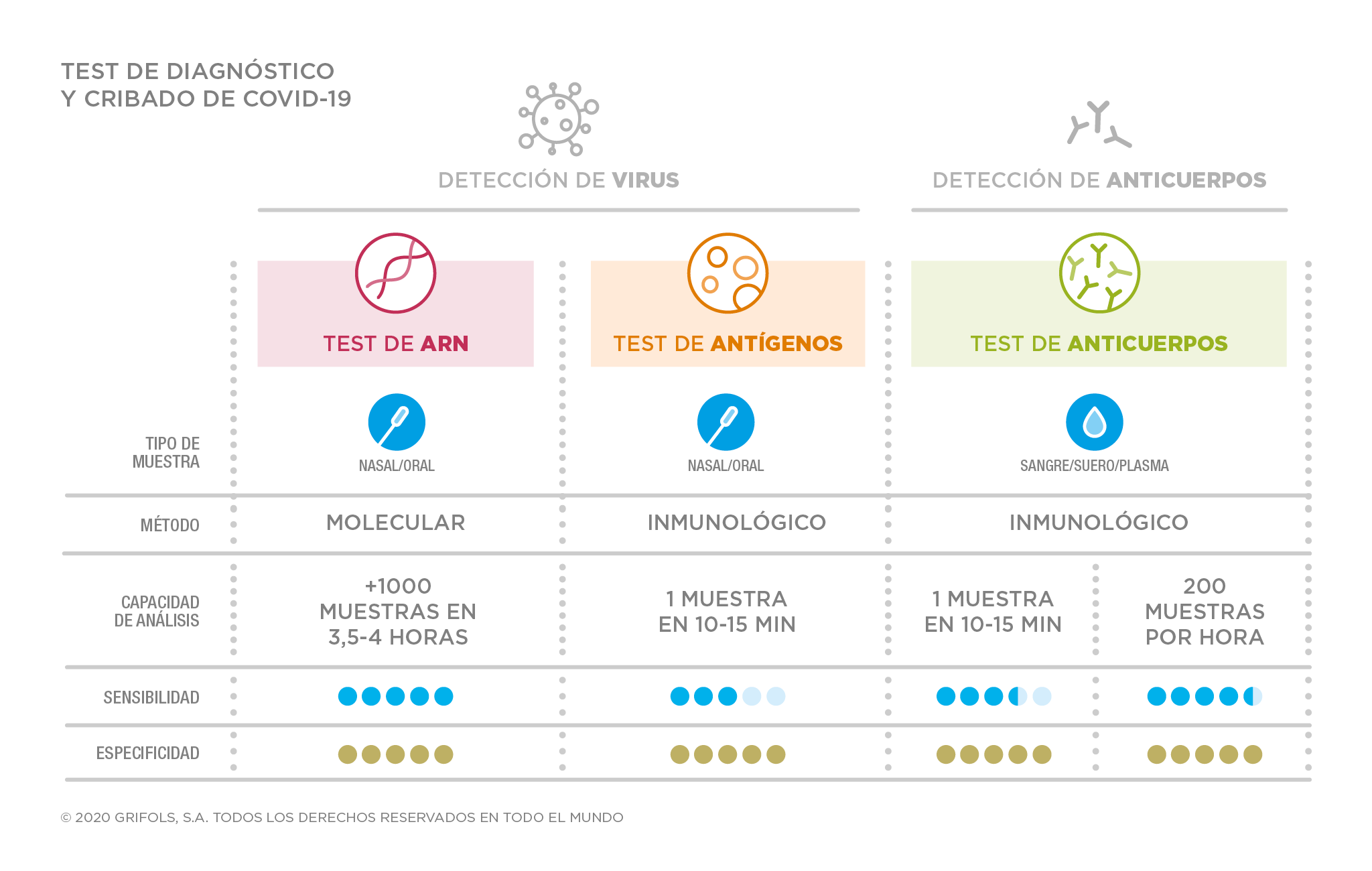
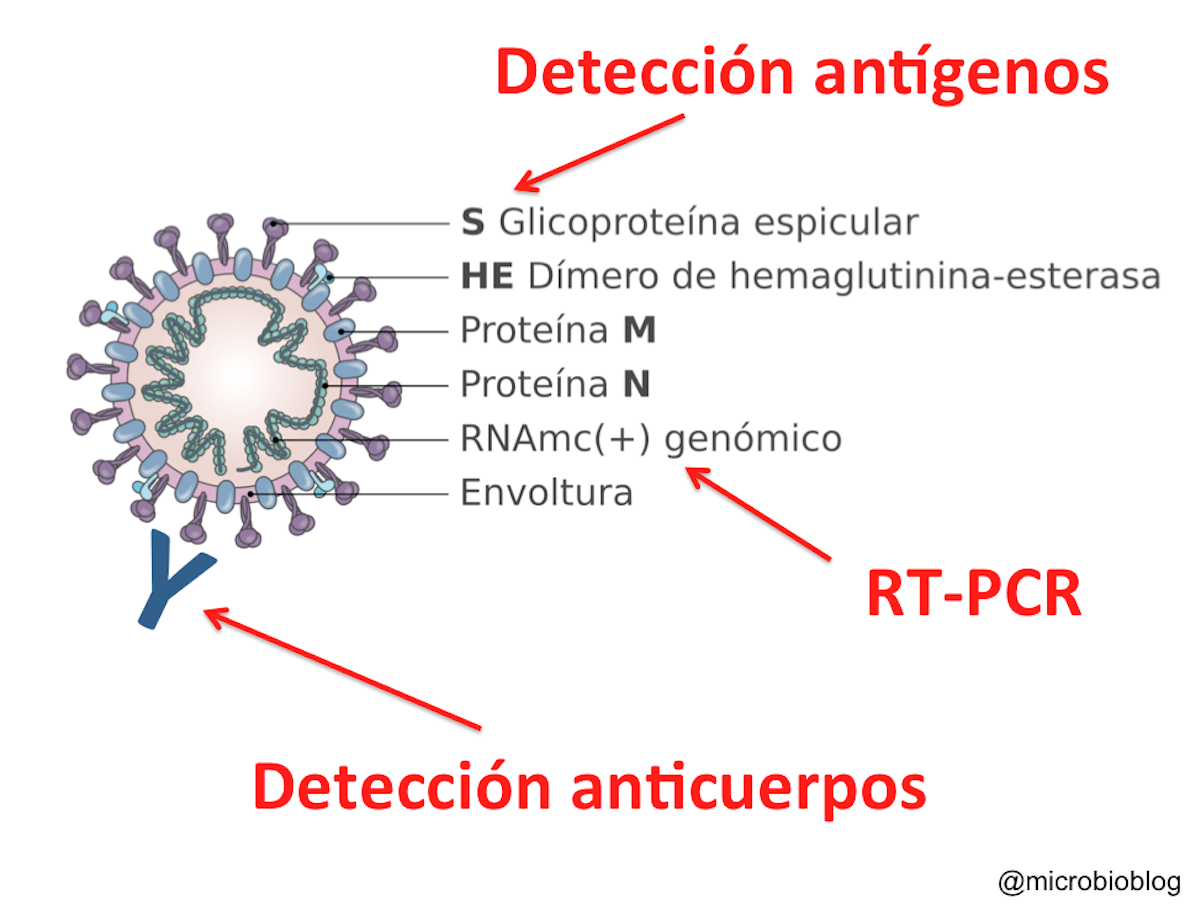
Las técnicas de detección se clasifican en varios tipos; unas encaminadas a encontrar la presencia del virus en el organismo (PCR, tests rápidos de antígenos, pruebas con saliva), y otras encaminadas a encontrar la presencia de anticuerpos generados por nuestro sistema inmunológico (tests rápidos de anticuerpos, ELISA, CLIA), que hayan sido creados como respuesta a la presencia de ese virus. Las técnicas están sujetas a parámetros que determinarán su fiabilidad, como son la sensibilidad, que es la capacidad de la prueba para detectar la enfermedad en individuos realmente enfermos, o la especificidad, que es la capacidad de la prieba para dar negativo en individuos que realmente están sanos.

Fuente: Wikipedia
Las pruebas se clasifican en varios tipos: test de ARN (busca el material genético del virus), test de antígenos (buscan la presencia de proteínas del virus), y los test de detección de anticuerpos generados contra el virus.
Los tests de detección del virus están encaminados a encontrar la presencia del virus (o parte de él) en nuestro organismo. La prueba más conocida es la denominada PCR (y también la más polémica), aunque hay otros métodos que también han sido utilizados. Un estudio de la Universidad de Pittsburgh (EEUU) indica que la media de tiempo en la que un paciente puede dar positivo son unas tres semanas (ver noticia).
a) PCR: Desde el inicio, la prueba por excelencia para detectar el virus ha sido la denominada PCR. Es la técnica considerada más fiable para detectar una infección por SARS-CoV-2, aunque tiene limitaciones, puesto que desde la toma de la muestra hasta que se obtiene el resultado deben pasar unas horas. Además, al principio de la primera ola de la pandemia, también había escasez de una sustancia necesaria para realizarla (llamada reactivo), y el alto número de muestras que se debían analizar por la proliferación exponencial de pacientes con síntomas junto con las máquinas disponibles por aquella época para realizar los diagnósticos, hacía que los resultados se pudieran retrasar no solo unas horas, sino varios días.
PCR es la abreviatura en inglés de “reacción en cadena de la polimerasa”, y es una técnica ideada en 1986 por el Nobel de Química Kary Mullis. Esta técnica se emplea para determinar paternidades, identificación de cadáveres y deteccción de enfermedades, como por ejemplo el VIH. En el caso del SARS-CoV-2, a diferencia de otros virus como el VIH que contienen ADN, el material genético es ARN, por lo que para poder realizar la pruebas de PCR primero hay que convertir el ARN en ADN, mediante una enzima (trasncriptasa inversa) que convierte el ARN monocatenario del virus en una cadena doble de ADN. Posteriormente, la máquina PCR calienta una mezcla provocando que la doble cadena de ADN se desenrede y desencadenando un proceso de duplicación de ese ADN, hasta obtener millones de copias. Finalmente, para detectar el código genético del virus, se emplean unos colorantes fluorescentes, que se añaden al tubo de ensayo mientras se copia el ADN, de forma que, si estaba presente el virus, el colorante se une al ADN y aumentaría su fluorescencia, emitiendo más luz de forma que se confirma el positivo cuando la fluorescencia supera cierto umbral.

Muchos la consideran como una prueba bastante fiable. Hay estudios que informan de que la fiabilidad de la PCR para la detección del SARS-CoV-2 se estima entre un 91% y un 98% (ver estudio). Hay también estudios que sugieren que, dado que no se conoce con precisión su sensibilidad y especificidad, las PCR son más útiles en el caso de arrojar un resultado positivo que confirma la infección, pero no tanto en caso de ser negativo, puesto que no se podría descartar por completo que no se tenga el virus (ver noticia) (ver estudio). Y es que, la PCR no cuantifica la infección (es decir, la cantidad de virus que hay en el organismo), sino que solo analiza su presencia en una muestra de sangre. Es por ello que, sobre todo, al inicio de la infección, las posibilidades de tener un falso negativo sean mayores, por la posibilidad de que el virus no se haya replicado en el organismo lo suficiente como para poder ser encontrado en la muestra sanguínea. Hay estudios que indican que la sensibilidad de la PCR disminuye bastante antes de la presencia de los síntomas, mostrando una probabilidad de falsos negativos del 100% en el primer día de infección, porcentaje que va disminuyendo hasta el día 8 de la misma, y comienza a subir de nuevo a partir del día 9 (ver estudios). La técnica incluso también puede arrojar falsos positivos o falsos negativos, por contaminación o degradación de la muestra tomada. No es infrecuente tampoco que pacientes recuperados, que dieron negativo en PCR cuando ya estaban recuperados, vuelvan a dar positivo algo más tarde, pero no se trataría, en muchos casos, de reinfecciones, sino que pueden ser fragmentos del ARN del virus que se encuentran ya en un estado que no es infectivo ni tampoco viable.
La PCR es una prueba que tiene ciertas limitaciones. Solo da información de si el paciente tiene parte del ARN virus en ese momento preciso, lo que implica que:
- no se puede determinar si lo tuvo en algún momento con anterioridad, en el caso de que sea negativo
- solo detecta presencia de parte del ARN del virus, por lo que un positivo no significa que necesariamente se esté pasando la enfermedad en ese momento (habría que confirmarlo con la presencia de síntomas o un estudio serológico de anticuerpos). Podría suponer un diagnóstico precoz (el virus está en las muestras nasofaríngeas pero aún no ha empezado a atacar al organismo), o un diagnóstico tardío (y lo que se detectan son restos del virus una vez superada la enfermedad)
En general, cuando un paciente tiene una carga viral importante y se encuentra en un momento en el que puede contagiar, la técnica encuentra una cantidad suficiente de virus, dando una señal fluorescente, cuando se llega a un determinado número de ciclos de amplificación relativamente pequeño (por ejemplo unos 20), que son cambios de temperatura que provocan que el ADN obtenido a partir del virus se duplique cada vez más. Pero si son necesarios muchos ciclos, por ejemplo 35, la probabilidad de que esos virus tuviesen capacidad infectiva sería mucho menor. Sin embargo, este parámetro no se especifica cuando se da el resultado de la PCR, y podría dar más información, acerca de la posibilidad de que el paciente positivo sea más o menos contagioso, con las repercusiones que ello pudiera tener. Algunas estimaciones cifran en cerca del 50% las PCR que serían "débiles", es decir, que corresponderían a pacientes con baja capacidad de contagiar.
No obstante, también hay incluso quien duda de su fiabilidad en otros aspectos (además de dudar de otras cuestiones relativas al virus). Es el caso de la plataforma llamada "Médicos por la Verdad" en España, que dudan de la fiabilidad de esta técnica en base a que se toma una muestra de ARN de solo 200 nucleótidos de los casi 30.000 que presenta el ARN del SARS-CoV-2. Además, el SARS-CoV-2 presenta una coincidencia en un 80% con el SARS-CoV, coronavirus responsable del SARS (ver noticia), por lo que planteaban dudas de si podría dar positivos en presencia de este otro coronavirus cuyo brote se consideraba prácticamente erradicado en 2004, aunque en realidad sí que hay proveedores de reactivos de laboratorio para realizar la prueba que aseguran tener kits para identificar el SARS-CoV-2 de manera específica, distinguiéndolo del SARS-CoV y otros coronavirus. Y también hay quien dice que los casos asintomáticos confirmados por PCR corresponderían a falsos positivos. Sin embargo, también hay científicos que rebaten los argumentos de esta plataforma, desmintiendo sus afirmaciones con otros datos, y argumentando que esta es una técnica fiable (ver artículo). En realidad, lo que hace la PCR es detectar una secuencia limitada pero específica de material genética, y para ello, para cada virus, se elige una secuencia distintiva, es decir, que no es compartida con ningún otro virus (es decir, la muestra buscada estaría dentro de ese 20% de material genético que no coincide con el SARS-CoV ni con ningún otro patógeno). La técnica busca esa secuencia, y empieza a hacer muchas copias de la misma, de forma que si la encuentra, habrá muchas copias y el resultado es positivo, y evidentemente, si esa secuencia no está en ningún otro virus conocido, difícilmente podrá dar positivo la prueba a no ser que se encuentre, de manera efectiva, el SARS-CoV-2, por lo que un falso positivo es algo que puede ocurrir con muy poca probabilidad en teoría. En concreto, la técnica rt-PCR usada incluye tres cebadores distintos, por lo que busca el ARN que codifica las proteínas S, N y ORF1 del virus (más otro cebador de control). Resultaría imposible un falso positivo a los tres indicadores (S, N y ORF1), e incluso se está alerta por si la prueba saliera negativa, para la proteína S, pero positiva para la N y la ORF1, puesto que podría ser un indicador de una mutación que afectara al antígeno S, es decir, a la proteína espiga. Otro tema es que pueda haber un error humano o que un contaminante entre en juego, en cuyo caso, incluso los mejores laboratorios podrían dar un falso positivo aunque con poca frecuencia, siendo más probable en laboratorios con menos experiencia (que han proliferado durante la pandemia). Según Michael Mina, sin embargo, la PCR permanece de 3 a 5 veces más tiempo siendo positiva que el tiempo que es contagioso una persona, por lo que una PCR positiva podría "interpretarse" como falso positivo con respecto al contagio, pero no porque no haya presencia de virus.
En el siguiente video puedes ver cómo es el proceso de toma de muestras para realizar la PCR. Aunque el proceso es seguro si se realiza correctamente, se ha llegado a documentar un caso de fuga de líquido cefalorraquídeo tras realizar un tes diagnóstico con muestra nasal (ver estudio), lo cual no debería dejar de ser un hecho aislado.
Otro dato importante a tener en cuenta es que una persona puede dar positivo en una PCR, pero ya no tener poder contagiador. Es decir, la capacidad de contagiar el virus tendría menos duración que el tiempo que este virus podría detectarse en una PCR. Y es que las PCR solo detectan la presencia del virus, pero no su viabilidad, es decir, si tiene capacidad infectiva.
Con respecto a los niños, se cree que su respuesta al virus difiere de la de los adultos, ya que algunos desarrollan síntomas de COVID-19 y anticuerpos específicos contra el SARS-CoV-2, pero nunca dan positivo para el virus en una prueba estándar de RT-PCR. Según se documenta en un artículo de Nature, en un estudio, tres niños menores de diez años de la misma familia desarrollaron anticuerpos contra el SARS-CoV-2, y dos de ellos incluso experimentaron síntomas leves, pero ninguno dio positivo en RT-PCR, a pesar de haber sido examinado 11 veces durante 28 días mientras estaba cerca. contacto con sus padres, quienes dieron positivo. Se cree que el sistema inmunológico de estos niños genera una respuesta inmune realmente rápida y eficaz que lo apaga, antes de que tenga la oportunidad de replicarse hasta el punto de que dé positivo en la prueba de diagnóstico con hisopo (ver artículo). Esto podría tener importantes implicaciones, como una infradetección de los casos reales en niños.
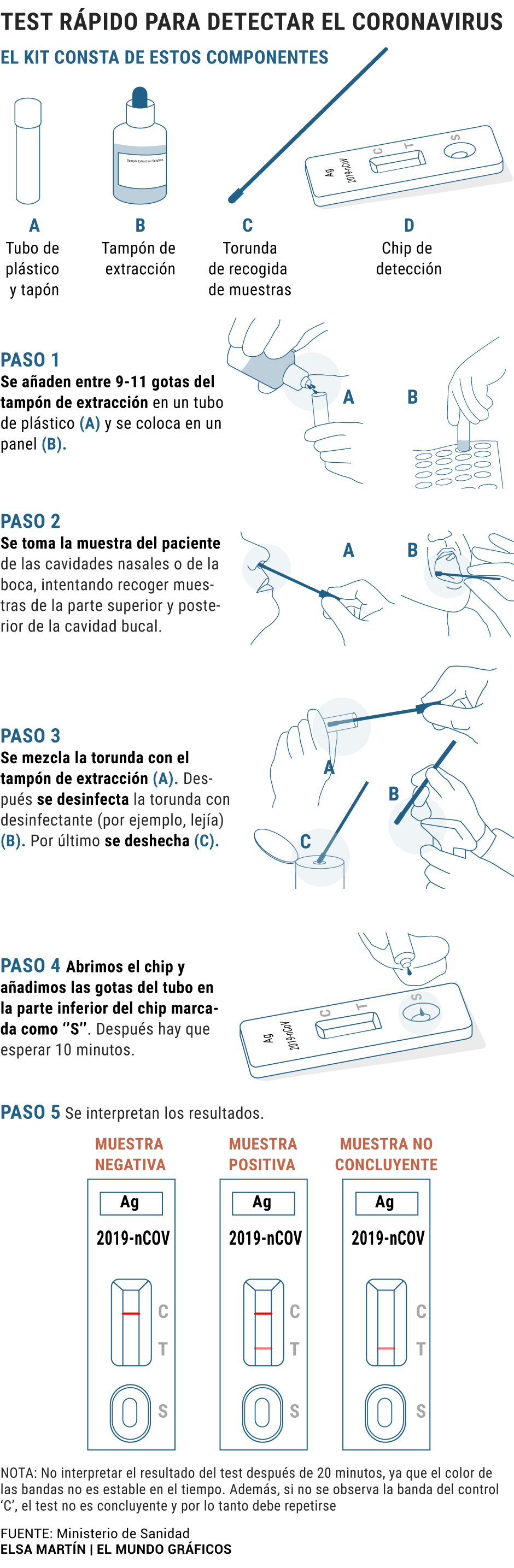
b) Test rápidos de antígenos: en este tipo de pruebas, llamadas de flujo lateral (LFD), a partir de muestras de las vías respiratorias, lo que se quiere detectar son las proteínas que hay en la cápside del virus (normalmente, la proteína S o espiga, o también la proteína N), y no el ARN del virus que está en el interior, como en el caso de la PCR. Se les llama rápidos porque pueden dar un diagnóstico en 10 o 15 minutos, pero es menos fiable que la PCR, y además, la sensibilidad (probabilidad de diagnosticar correctamente a un portador) varía a lo largo de las etapas de la infección, siendo más fiable la detección cuando hay síntomas. Por ello, no se considera un test diagnóstico concluyente, requiriendo la realización de PCR en caso de sospecha.
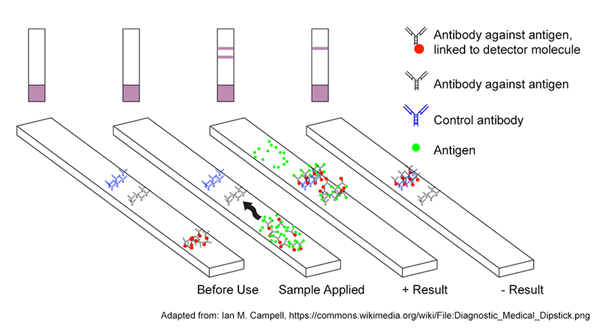
El funcionamiento de estas pruebas partía de la utilización de anticuerpos para distintas proteínas estructurales del SARS-CoV (principalmente la S y la N) que también reconocen el nuevo SARS-CoV-2. Utilizando unas tiras reactivas (parecidas a un test de embarazo), se disponen en bandas estos anticuerpos, y al entrar en contacto con el virus, si lo hay en la muestra, se produce una reacción entre ambos, produciendo un cambio de color en la zona de detección, de forma que el resultado se interpreta de forma visual.
Durante la primera ola, algunos de estos tests registraron una sensibilidad por debajo del 30%, por lo que no se consideraban demasiado efectivos (ver noticia).
Fuente: ElMundo.es
En la tira cromatográfica hay tres sustancias, una barra de control que contiene anticuerpos de control, una barra de detección que contiene anticuerpos específicos contra el virus, y un anticuerpo unido a una molécula que hará que se una a la barra de control donde está el anticuerpo de control cuando la muestra se desplace por la tira. Esta última barra se marcará para identificar que el proceso se ha realizado correctamente. Si en la muestra hay unidades del virus, se unirán a la barra de detección, detectándose así el positivo.
Sin embargo, los nuevos test de antígenos que empezaron a distribuirse en el tercer trimestre del año demostraron ser más fiables que los que se empezaron a comercializar en marzo. La sensibilidad podría estar en el 93'3% y la especificidad en el 99'4%, siendo más sensible si la muestra se toma en los cinco primeros días. En noviembre, una investigación liderada por el infectólogo Oriol Mitjà en el Hospital Germans Trias i Pujol de Badalona, señalaba que los nuevos tests (de la compañía Abbott) habían identificado certeramente la mayoría de casos potencialmente infecciosos, tanto si tenían síntomas como si se trataba de casos asintomáticos. Siendo tests más rápidos y baratos, podrían ser útiles para controlar la pandemia antes de tener una vacuna efectiva. En la investigación se vio que en las PCR un 68% de los casos eran positivos, pero los test de antígenos dieron positivo en el 62% de los casos. Esta menor sensibilidad sin embargo se consideraba una ventaja según el estudio, pues se llegó a la conclusión de que en el 99% de los casos potencialmente contagiosos, los test de antígenos dieron resultado positivo. Además, estos test de antígenos detectaron en un 90% los casos que se cree que tienen un potencial contagiador significativamente menor, y en los casos en los que la PCR es positiva pero ya no hay riesgo de contagiar, los test caían a un 57% en su detección, pero esto no sería trascendental, porque lo que interesa es detectar a los casos que pueden contagiar y romper las cadenas de transmisión. Esto podría contribuir significativamente por tanto al control de la epidemia (ver artículo).

Otro ejemplo de test rápido de antígeno con buenos resultados es el "Innova SARS-CoV-2 Antigen Rapid Qualitative Test", prueba de flujo lateral probada en Liverpool en otoño de 2020 con muy buenos resultados, mostrando una especificidad del 99'7%, una tasa de falsos positivos de solo el 0'32%, sensibilidad general del 76,8% para todos los individuos con PCR positiva, y capacidad para detectar más del 95% de los individuos con cargas virales elevadas (ver web).
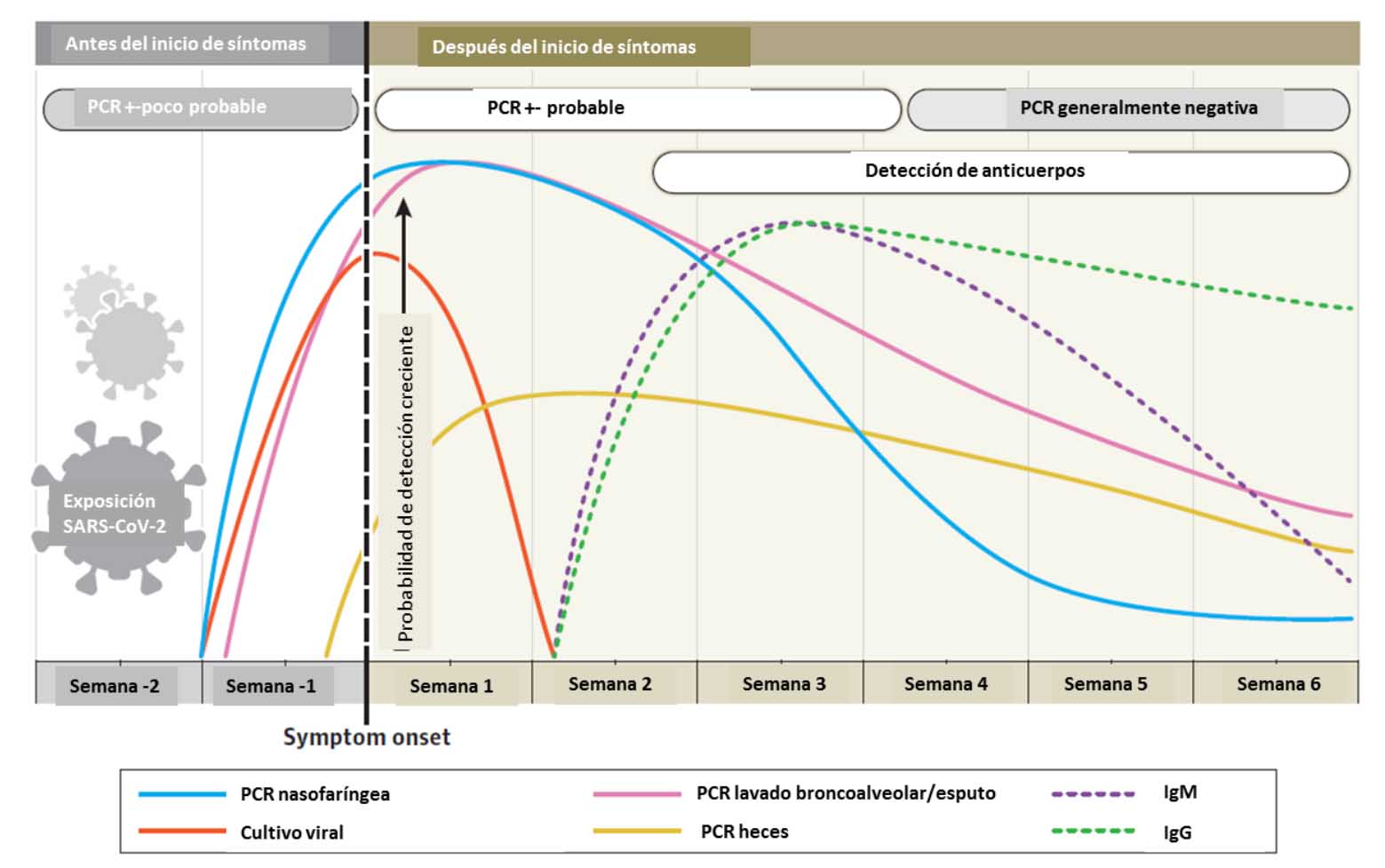
En la siguiente infografía puedes ver cuándo están indicados los test rápidos y las PCR de manera comparativa: los test rápidos serían para cargas virales más altas en general que las PCR, por lo que tendrían menor periodo para ser efectivos, casi coincidiendo con el periodo en el que el contagiado puede infectar a otras personas. Las PCR darían positivos durante más tiempo, y detectan cargas virales más bajas, pero podrían dar positivo cuando el paciente ya no podría contagiar.
Fuente: New York Times
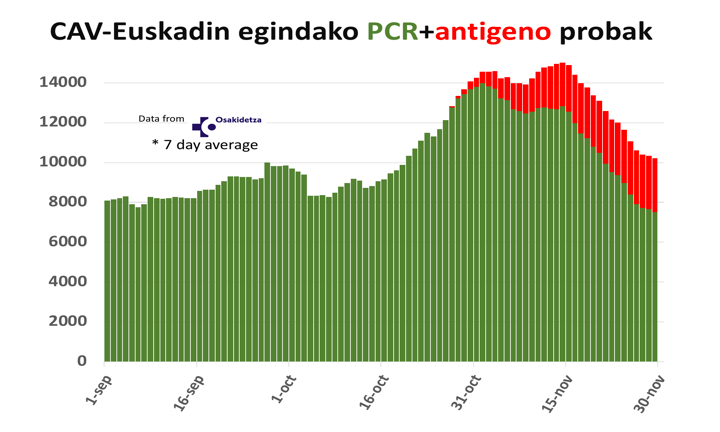
Algunos expertos señalaron la introducción de estos nuevos tests de antígenos más fiables como posible motor del descenso de contagios desde finales de noviembre, lo que podría estar vinculado a una mayor rapidez de la respuesta, pues el resultado se obtiene antes que con una PCR convencional, lo que permite aislar a contagiados y poner a cuarentena a los contactos estrechos unos días antes.
Descenso de casos en País Vasco al introducir test de antígenos. Fuente: @Ugo_Mayor
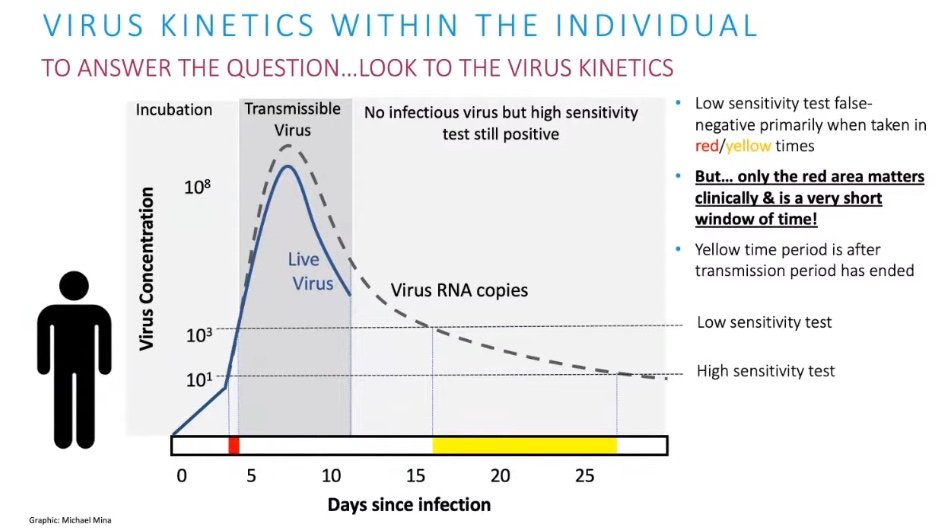
Es cierto que hay quien piensa que el uso generalizado de estos test de antígenos puede no ser una buena idea. María I. Tapia explicaba sin embargo por qué sí sería aconsejable su uso, basándose en lo expuesto por Michael Mina, científico de la Universidad de Harvard, quien señala que "es cierto que los test de antígenos son unas 1000 veces menos sensibles a nivel molecular que la PCR. Visto así, parecen muy malos". Pero cuando el virus entra en el cuerpo humano, al principio, es indetectable para cualquier test, pero luego crece exponencialmente exponencialmente en el organismo de la persona, por lo que en cuestión de horas, el virus superará los umbrales para ser detectado tanto por la PCR como por el test de antígenos (pudiendo superar este último apenas unas horas después), siendo entonces, en ese pico, cuando el virus es fácilmente transmisible a otras personas.
En la imagen anterior, los días marcados en amarillo (15 a 25), la gente podrá tener una PCR positiva con facilidad (High sensitivity test), pero no se están detectando virus, con capacidad infecciosa, pero sin embargo no serán detectados fácilmente por los test de antígenos. Sin embargo, los test de antígenos funcionan muy bien en los días en los que la persona es contagiosa. Según Mina, cuando el cuerpo llega a unas cantidades enormes de virus, de billones o trillones, no se pueden soportar más replicaciones. El problema podría estar justo al principio, en la zona antes de los 5 días desde el contagio marcada en roja en la gráfica. En esa fase, muy corta, posiblemente menos de un día, la PCR podría ser positiva y el test de antígenos negativo. Pero, ¿qué sucede?. Pues que si se practica una PCR en ese periodo, el resultado podría tardar 2 o 3 días, mientras que al día siguiente de practicar esa PCR se podría repetir un test de antígenos y obtener el resultado positivo en cuestión de minutos, antes que el resultado de la PCR practicada el día anterior. Por tanto, parece más adecuado su uso que el de las PCR, porque permitirá una respuesta más rápida y efectiva, ya que se calcula que el 70% de la gente con PCR positiva ya no están en fase contagiosa (además, habría que sumar que puede que el 80% de los que sí están en fase contagiosa, según estudios, puede que no transmitan mucho el virus), y el objetivo es detectar gente infecciosa, con o sin síntomas (los test parecen funcionar bien en ambos casos). Por tanto, parece que los test rápidos de antígenos pueden ser una herramienta muy potente para capturar a las personas infecciosas, incluso a las asintomáticas. Michael Mina propone que estos test puedan ser baratos, y estar disponibles de manera fácil al ciudadano, para detectar si están infectados de manera temprana, en casa, y así romper las cadenas de transmisión. La frecuencia sería fundamental, pues si bien un test de antígenos podría dar una "foto fija" de la situación, hechos con frecuencia, serían una "acumulación de fotogramas" y se convertirían en película.
Por tanto, un uso generalizado de test rápidos de antígenos (no de anticuerpos) en el hogar podría contribuir a frenar significativamente las cadenas de contagios, siempre y cuando fueran asequibles para la población, y con facilidad de uso (parecido a un test de embarazo).
Fuente: @mariaitapia
El 1 de febrero de 2021, la FDA americana autorizó la venta de un test de antígenos de autodiagnóstico para el hogar, lo cual podría ser interesante para frenar las cadenas de contagio (ver noticia).
c) Pruebas de saliva: la saliva podría tener un papel diagnóstico fundamental en los próximos meses, ya que podría utilizarse para procedimientos de detección del virus de forma no invasiva, al contrario que la PCR tradicional (ver artículo). Existe evidencia que SARS-CoV-2 se multiplica en la lengua y glándulas salivales, cuyas células son ricas en receptores ACE2. Incluso hay estudios que hablan de una mayor sensibilidad de la prueba de saliva que la propia PCR (ver estudio), y otros que realizando una comparación entre PCR y test de saliva, encontraron una concordancia de resultados del 97'4%, lo que sugiere que es una alternativa bastante fiable y válida, si bien el virus tiende a desaparecer antes de la saliva que de las muestras nasofaríngeas (ver estudio). Ya se han aprobado test de salivas en algunos países del mundo, como por ejemplo, en Estados Unidos, donde la Agencia Americana del Medicamento o FDA aprobó su uso en abril (ver noticia). En agosto también se publicó un prometedor método sensible y barato en medRxiv (ver publicación), e Israel anunció también que había desarrollado un test ultrarápido que se practicaría con saliva, de forma que una vez tomada la muestra, el diagnóstico estaría en apenas un segundo. En septiembre el CSIC anunció que estaba desarrollando un test de saliva que tendrá como características su rapidez (dará el resultado en segundos), su autonomía (no se necesitan conocimientos previos para realizarlo), y portátil (ver noticia).
Además, a mediados de agosto, la FDA estadounidense aprobó un nuevo y barato test rápido de saliva desarrollado en Yale (ver noticia), probada incluso en jugadores de la NBA. Se trata de un protocolo denominado Saliva Direct, y funciona tomando muestras de saliva, y no muestras nasofaríngeas que son incómodas para los pacientes (lo cual supone un menor riesgo de contagio para los profesionales sanitarios). Estas muestras no necesitan caros conservantes, por lo que el coste de la prueba se reduce, y tampoco necesita extraer el ARN de las muestras antes del testeo, algo que también es costoso y que requiere bastante tiempo, además de la escasez de productos para poder realizar este proceso. El objetivo es que la muestra de saliva pase directamente a la comprobación de la presencia del virus mediante PCR.
![]()
Fuente: Covidtrackerct.com
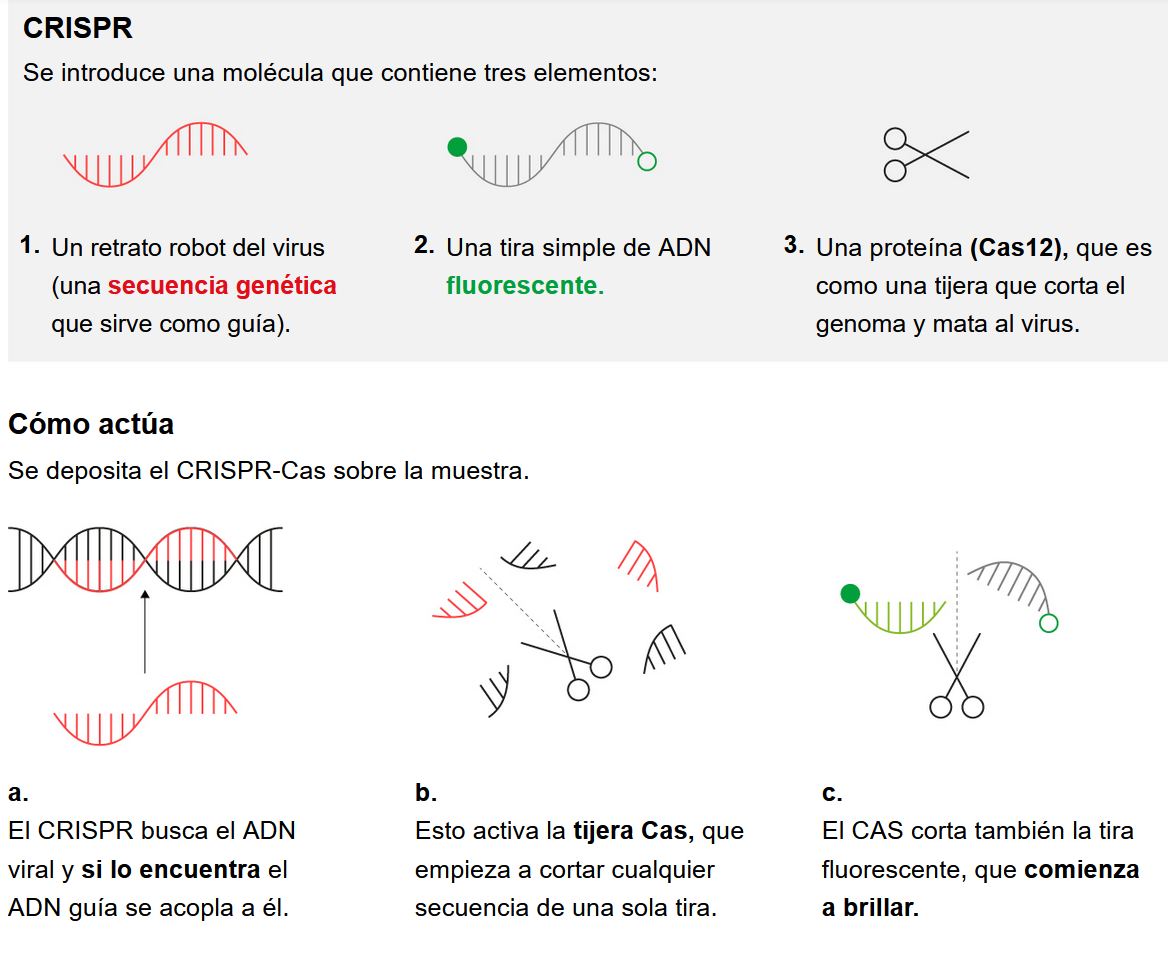
d) Prueba de detección usando la técnica CRISPR: varios equipos a lo largo del mundo están desarrollando test basados en la técnica CRISPR, una técnica que permite "recortar" y "pegar" trozos de material genético en ácidos nucleicos (ARN y ADN). Muchos de ellos se basan en una amplificación del ARN del virus, lo que requiere tiempo y reactivos, pero en ctubre de 2020 se anunció el desarrollo, por parte de Jennifer Doudna, recién galardonada con el Premio Nobel, junto a otros investigadores de la Universidad de Berkeley (EEUU), de una prueba experimental diagnóstica basada en la técnica de edición genética CRISPR, que no requería amplificación del ARN, por lo que sería un método más rápido, sencillo y económico. Esta prueba podría diagnosticar la enfermedad en tan solo cinco minutos. Dicha prueba aportaría ventajas a los métodos usados previamente: es pequeña, portátil, no requiere personal experimentado, no requiere de sofisticados equipos de diagnóstico, y se diagnosticaría el resultado usando la cámara del teléfono móvil, lo que permitiría su uso fuera de entornos sanitarios. Pero además, podría cuantificar la presencia del virus en la muestra, lo que daría información acerca de la fase de la infección en la que se encontraría el contagiado, por lo que se podría saber si en ese momento tendría potencial contagiador y sería recomendable su aislamiento, o si, por el contrario, ya no sería capaz de contagiar. Todas estas ventajas sobre la tradicional PCR podrían hacerle ganar terreno en un futuro no muy lejano frente a los test tradicionales. En las primeras pruebas (ver artículo), se detectó correctamente la infección en cinco pacientes en menos de cinco minutos, aunque se cree que si existen muestras con menos cantidad de virus, habría que esperar hasta un máximo de treinta minutos.
El test pretende detectar el material genético del virus, igual que las PCR. Se parte de un pequeño fragmento de ARN del virus "recortado" con tecnología CRISPR, por acción de la enzima Cas13, que actúa como unas "tijeras" para obtener este fragmento, y al realizar el corte se libera una partícula fluorescente que se ha introducido en la muestra, de modo que aplicando un pulso de luz láser, este material fluorescente se ilumina, y la luz podría ser capturada con la cámara del teléfono móvil. Cuanta mayor es la luz, más carga de virus habría en la muestra.
Fuente: El País
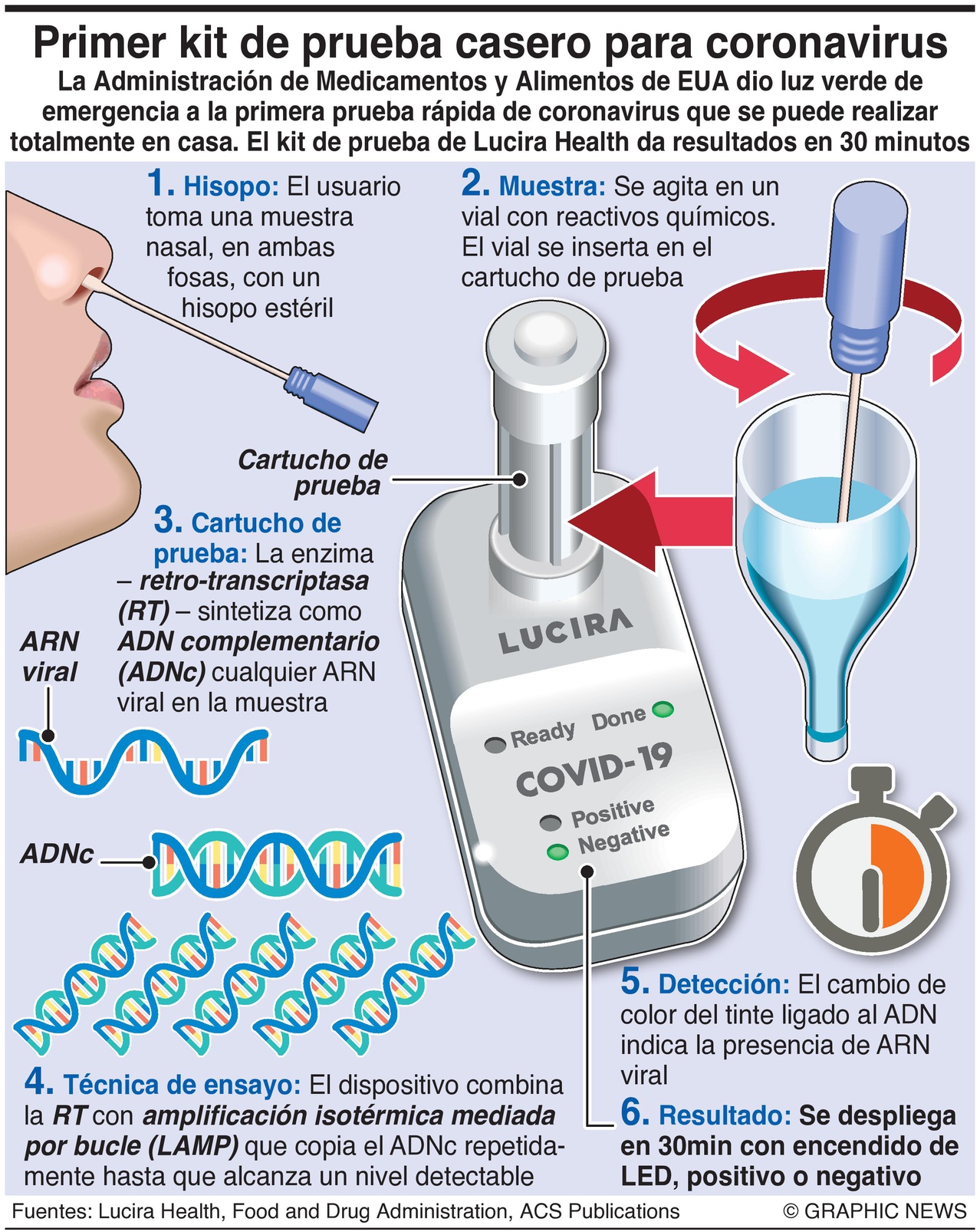
e) Técnica LAMP (Loop mediated isothermal amplification): En agosto se presentó una nueva técnica, denominada técnica LAMP, desarrollada por el Institut Pasteur de Montevideo junto con la Facultad de Ciencias y Facultad de Química de la Universidad de la República, en Uruguay, con una sensibilidad comparable a las de las RT-PCR. A partir de muestras de hisopado (como en el caso de la PCR), se produce la amplificación del ácido nucleico. Este método permite la detección de plantillas de ADN y ARN en aproximadamente 1 hora, superando la eficiencia de la técnica RT-PCR. Si bien el costo de reactivos es similar entre LAMP y RT-PCR, el costo en equipamiento que se requiere para LAMP es menor. La lectura de los resultados de esta nueva técnica puede darse a simple vista, ya que el reactivo cambia de color rosado (negativo) a amarillo (positivo) en presencia del virus. En noviembre, la FDA americana aprobó el uso de la prueba LUCIRA, basada en esta técnica, para su uso en el hogar (ver noticia).
e) Pruebas TMA (Amplificación Mediada por Transcripción): En diciembre se comenzaron a usar las pruebas TMA, un test molecular creado por la farmacéutica Grifols, que detecta presencia del virus a través de una muestra tomada mediante hisopo nasal, con la misma fiabilidad que una PCR, pero de forma más rápida y precisa, con un tiempo de diagnóstico de unas 2 horas (menos que la PCR). Mientras que la PCR convierte el ARN del virus en ADN para medirlo, la TMA busca el ARN directamente, lo que reduce el tiempo de diagnóstico, y además, es algo más económica.
f) Test de diagnóstico anales: a finales de enero de 2021, en China empezaron a utilizarse estos test. La principal diferencia con respecto a otros es el método empleado para la extracción de la muestra, que se obtiene por vía rectal en un proceso que dura unos segundos. Según el criterio de algunos expertos, supone una mejora en la detección de la presencia del virus, ya que sería detectable durante más tiempo en esta zona que en las vías respiratorias altas.
FuenteGuía para entender las diferencias entre los 3 principales test de covid-19
xisten dos tipos de test rápido, los que se realizan a través de la muestra sanguínea, que detectan anticuerpos producidos frente a la infección; y por otro lado a través de muestras respiratorias, que detectan proteínas del virus, siendo estos últimos los menos sensibles.
Leer más: https://www.infosalus.com/asistencia/noticia-guia-entender-diferencias-principales-test-covid-19-20200502075935.html
(c) 2020 Europa Press. Está expresamente prohibida la redistribución y la redifusión de este contenido sin su previo y expreso consentimiento.
Mientras que las PCR buscan el ARN del virus, y los test de antígenos las proteínas de la membrana del virus (y por tanto, solo pueden detectar una infección actual), los tests de anticuerpos no buscan el virus, sino unas células generadas por el sistema inmunitario del paciente que serían la respuesta para combatir ese virus (por lo que pueden dar información no solo de una infección actual, sino también ya superada). En realidad, buscan dos tipos de anticuerpos: inmonuglobulinas de tipo IgM e inmunoglobulinas de tipo IgG, específicas para el SARS-CoV-2. Estos anticuerpos 'encajarían' perfectamente con las proteínas del virus, de forma que se unen a él y lo desactivan. En concreto, los primeros en aparecer son los de tipo IgM (a los 6 o 7 días después de la infección), cuando se está combatiendo la infección, pero también son los primeros en desaparecer cuando se supera. Más tarde, aparecen los IgG (15 días aproximadamente después de la infección), que tienen una durabilidad mayor. Se especulaba con que pudieran durar uno o dos años, pero recientes estudios cifran su fecha de caducidad en algunos meses, habiendo estudios que los cifran en dos o tres meses (ver noticia), y otros que elevan ese periodo hasta los seis meses (ver estudio). También hay estudios que indican que, en casos leves, tras 3 meses desde el inicio de síntomas, los pacientes no solo mantienen la inmunidad humoral, es decir, anticuerpos IgG, sino que también mantienen inmunidad celular a través de linfocitos T (ver estudio).
Fuente: inmunologia.org
Un resultado con IgM positivo sugiere que se está pasando la infección (si es con IgG negativo, en una fase temprana). Un resultado con IgG positivo e IgM negativo sugiere que se ha superado la infección. Es importante saber que no deben utilizarse para saber si se es contagioso o no, porque, aun en el caso de que den un resultado correcto, tienen limitaciones como se comentará a continuación.
Dentro de este tipo de pruebas, existen varias técnicas:
a) Test rápidos de anticuerpos (ensayos de flujo lateral inmunocromatográfico): requieren una gota de sangre del paciente, típicamente mediante un pinchazo en un dedo de una mano. Esa gota de sangre se deja caer dentro del dispositivo (parecido también a un test de embarazo), y posteriormente se añaden unas gotas que ayudan a que la muestra de sangre fluya a través del dispositivo. Conforme se mueve la muestra por él, los anticuerpos que puedan estar presentes se capturan en diferentes líneas de control, produciendo una o varias líneas con las que se interpreta el resultado. Los resultados posibles son cuatro: IgG e IgM negativos (no se ha contraído el virus), IgM positivo e IgM negativo (infección en estado inicial), IgM e IgG positivos (infección en curso en estado más avanzado), e IgM negativo e IgG positivo (infección superada). Presentan como ventajas la rapidez diagnóstica (unos minutos) y la sencillez de la toma de la muestra, pero por contra, tienen una fiabilidad limitada y debería hacerse una PCR de confirmación en caso de sospechar que hay una infección en curso. Además, la fiabilidad y sensibilidad varía según fabricantes y días de infección. El Consejo Superior de Investigaciones Científicas de España (CSIC) afirmó en julio haber desarrollado uno con un 98% de fiabilidad (ver comunicación).


b) Inmunoensayo ELISA: estas pruebas (ya usadas previamente para la detección de otros virus) utilizan unas enzimas que unidas a los anticuerpos causan un cambio de color que puede ser medido, de forma que la fuerza del cambio de color es proporcional al número de anticuerpos de la muestra analizada. En este tipo de pruebas, la muestra se realiza extrayendo un tubo de sangre del paciente (no basta con un pinchazo en el dedo). Durante el proceso de detección, lo que se busca es un cambio de color para detectar positivos. Suponen una técnica simple y barata, bastante fiables, y los resultados se pueden obtener de forma relativamente rápida. Además, permiten evaluar a muchos pacientes a la vez. Su sensibilidad se estima en más de un 95%, por lo que es una prueba más aconsejable que los test rápidos.
c) Inmunoensayo CLIA: es una técnica parecida a ELISA, pero mientras que ELISA es una prueba de alta sensibilidad, el inmunoensayo CLIA se considera ultrasensible (es decir, aún más fiable). La señal que emite la enzima acoplada al anticuerpo de detección es un cambio de luz, a diferencia de ELISA, que mide un cambio de color. Este tipo de ensayo requiere un equipamiento específico con lector de luz de quimioluminiscencia.
Cuando se realizan pruebas ELISA/CLIA, es importante valorar el resultado. Aunque se encuentren valores superiores a 0, el positivo en IgG o IgM se considera una vez que se alcanza un determinado umbral. Además, estos umbrales pueden variar en función de los laboratorios (ver noticia).
Las recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica sugieren que los ensayos CLIA o ELISA son más fiables que los test rápidos de anticuerpos, en base a investigaciones realizadas por el ISCIII, siendo recomendadas frente a estos tests especialmente en el ámbito sociosanitario (ver recomendaciones).
Fuente: diariosanitario.com
En agosto, un estudio publicado por el Centro de Cáncer MD Anderson de la Universidad de Texas (EEUU), advirtió que determinadas pruebas serológicas podrían estar induciendo a resultados equívocos. Existen varios tipos de anticuerpos de isotipo IgG según la zona del virus a la que se unen: por un lado, existen unos anticuerpos S-RBD, que se unen a la proteína espiga y se especula con que neutralizan la infección del virus. Pero también hay otros anticuerpos, como por ejemplo los que se unen a la proteína N de la nucleocápside del virus, que podrían indicar únicamente exposición al virus, pero no protección contra la reinfección. Dicho estudio partía de los hallazgos realizados a través de pruebas ELISA en 138 muestras de casos confirmados y hospitalizados de COVID-19, y otras 464 muestras de pacientes sanos y sin COVID-19. Los resultados mostraron que el 3% de los pacientes sanos daban positivo en anticuerpos de proteína N, pero solo 1'6% de ellos tenían los S-RBD. La capacidad de neutralización de los anticuerpos fue:
- Un 86% de las muestras con anticuerpos S-RBD tenían capacidad neutralizante (es decir, pueden prevenir una reinfección)
- Un 74% de las muestras con anticuerpos para la proteína N tenían efecto neutralizante
- De las muestras en las que había ambos tipos de anticuerpos, la capacidad neutralizante era del 96'5%
En base a estos hallazgos, el estudio sugeriría que la detección de anticuerpos de la proteína N no siempre estaría relacionada con la capacidad neutralizante que muestran los anticuerpos S-RBD, y dado que hay muchos test serológicos que solo buscan anticuerpos de la proteína N, podría estar dándose un positivo que daría a entender que hay inmunidad, cuando realmente no es así y lo único que estarían indicando es exposición al virus (ver estudio).

Sensibilidad de cada test según inicio de síntomas: Fuente: newtral
Como se ha dicho antes, es importante saber que no deben utilizarse para saber si se es contagioso o no, puesto que con la evidencia actual, existen varias limitaciones:
- Cuando hay un valor positivo de IgM, hay infección activa, pero esto no implica contagiosidad. De hecho, parece que los individuos son más contagiosos días antes de empezar a poder detectarse IgM. Por ello, si lo que se quiere es saber si se puede contagiar en un momento determinado, es preferible un test rápido de antígenos, que da positivo en fechas más cercanas al periodo infeccioso. Sin embargo, la IgM, como la PCR, puede ser positiva cuando hay virus en el organismo pero no se tiene capacidad infecciosa.
En agosto, una compalía de Cardiff (Gales) denominada Indoor Biotechnologies, en colaboración con la Universidad de Cardiff, comenzó a desarrollar un test para detectar células T, que podrían proporcionar inmunidad a largo plazo, más incluso que las pruebas de anticuerpos (ver noticia). Estas células o linfocitos T son, como ya se ha comentado, desarrolladas durante la infección, y pueden crear más anticuerpos en caso de reinfección. Es útil porque, dado que se ha comprobado en estudios que los niveles de Ig pueden desaparecer con el paso de los meses, podría en ese caso quedar inmunidad por tener este tipo de células en el cuerpo. Durante las pruebas, la compañía comprobó que varias personas que habían pasado la COVID-19 y daban negativo en los test de anticuerpos, sin embargo, daban positivo en un test de células T, por lo que podrían tener mças inmunidad de lo que se pensaba previamente, y además, más duradera (posiblemente varios años).
Una de las herramientas que se ha propuesto es la de realizar test masivos entre la población para controlar el virus, si bien es un tema polémico, que no se considera del todo útil, por varios factores:
- Supone una gran inversión económica, casi inasumible
- Los test, incluidos las PCR, no son 100% fiables
- Puedes ser negativo en el momento de la prueba, y contagiarte justo al salir de la misma
- No es factible realizar PCR en un corto periodo de tiempo a toda la población.
Cuando interesa hacer test a un conjunto de la población, para ahorrar costes, se propone el llamado pool testing, que consiste en analizar varias muestras de personas con un único test. Si el test es negativo, todas las personas se consideran sanas con un único test. Si es positivo, se repiten test individuales a solo los sospechosos, para confirmar los positivos.
Sin embargo, la necesidad de realizar tests a gran parte de la población vendría avalada por un estudio llevado a cabo por investigadores de distintos países señala que, para evitar una posible saturación del sistema sanitario, sería necesario identificar al menos hasta un 50 por ciento de los casos positivos mediante tests, y llevar a cabo un rastreo de al menos el 40 por ciento de los contactos de esos casos positivos (ver noticia).
Como dato curioso, recalcar que también se están entrenando perros para que puedan detectar la COVID-19 (ver noticia). Un estudio preliminar de la Escuela Superior de Veterinaria de Hannover, la Hannover Medical School y las fuerzas armadas alemanas, mostraba que perros debidamente entrenados podían distinguir muestras de saliva de personas infectadas con el virus y muestras no infectadas, con una precisión nada desdeñable del 94%. En Finlandia comenzaron a usarse en septiembre para detectar a pasajeros con el virus en los aeropuertos, habiendo detectado incluso casos asintomáticos en cuestión de pocos segundos (ver noticia).

Fuente: El Español
Para adelantarse también a la detección, surgió en agosto en España un movimiento enfocado a desarrollar una estrategia integral, donde un grupo de profesionales de la salud, académicos y empresarios coordinados por el doctor César Carballo, proponen una estrategia más activa y predictiva en busca del virus y de casos positivos, apostando por las apps de rastreo y por en análisis pormenorizado de las aguas residuales como elemento fundamental de búsqueda de casos positivos, aprovechando el trabajo de la empresa española Global Ómnium. Esta técnica ha demostrado que se puede encontrar el virus en aguas residuales de zonas de las ciudades hasta dos semanas antes de que se empiecen a dar casos positivos por PCR en esos lugares, por lo que su uso generalizado puede anticipar la detección. Esta teoría de las aguas residuales ha sido también avalada por investigadores de la Universidad de Santiago de Compostela (ver noticia). Como ejemplo, el análisis de aguas residuales permitió identificar a dos positivos asintomáticos en la Universidad de Arizona (ver noticia). Más tarde, ante la tercera ola, surgió Una estrategia integral 2 (ver), realizada por 38 expertos.
En octubre se anunció la autorización en EEUU de una prueba (Xpert Xpress SARS-CoV-2/Flu/RSV) de la compañía Cepheid que podría realizar conjuntamente un test para SARS-CoV-2, gripe A y B, y virus sincitial respiratorio, que puede proporcionar resultados en tan solo 35 minutos, para la que habría que tomar muestras con hisopos nasofaríngeos y nasales.

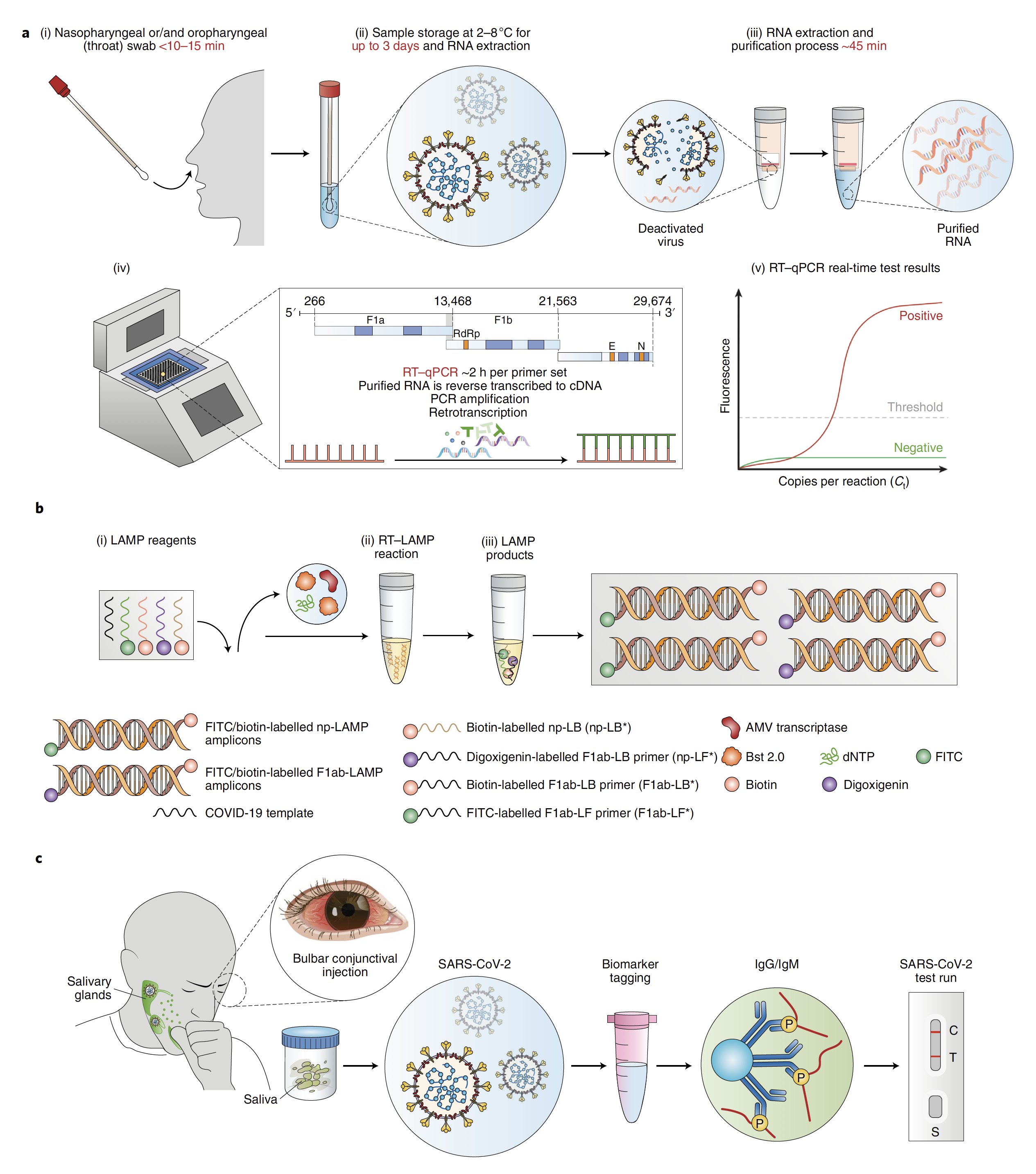
En la siguiente infografía, puedes ver un resumen de las técnicas de detección (fuente: Nature).
En abril de 2021, se supo que DARPA (Agencia de Proyectos de Investigación Avanzados de Defensa estadounidense), había desarrollado un chip subcutáneo (que se introduce bajo la piel con cirugía sencilla), que podría detectar la presencia del virus incluso antes de empezar a notar síntomas. Podemos tener la información necesaria en cuestión de minutos para frenar la infección antes de que vaya a más, de forma que iría analizando la sangre permanentemente.










 Factores de riesgo
Factores de riesgo Técnicas de detección
Técnicas de detección Tratamientos
Tratamientos Vacunas
Vacunas Carga viral
Carga viral Mutaciones
Mutaciones Letalidad y mortalidad
Letalidad y mortalidad Prevención: mascarillas
Prevención: mascarillas Prevención: Ventilación y filtración (HEPA)
Prevención: Ventilación y filtración (HEPA) Otras medidas de prevención
Otras medidas de prevención Impacto de la pandemia
Impacto de la pandemia Fin de la pandemia
Fin de la pandemia Prevención en centros educativos
Prevención en centros educativos Enlaces de interés
Enlaces de interés





