Última actualización: 16 de abril de 2021
Tras un año de pandemia, en donde el virus estaba más o menos expandido en distintos países del planeta, se acabaron imponiendo distintas corrientes para abordar la expansión del virus. Mientras algunos abogan por una estrategia Covid cero, basada en el control y máxima supresión de la transmisión (como han hecho países como Corea del Sur, Taiwán, Nueva Zelanda, Singapur o Vietnam), cuyo objetivo es mantener los contagios al mínimo y, eliminarlo si procede, en áreas geográficas concretas (ver artículo), otras corrientes apuestan por 'dar por imposible' el control del virus en zonas donde ya esté muy expandido, buscando, de alguna manera, la inmunidad de rebaño (natural o por vacunación), minimizando el impacto del virus en la medida de lo posible. En estos términos se redactó la declaración de Great Barrington, basada en la idea de que las políticas de bloqueo producen efectos devastadores en la salud pública a corto y largo plazo, como empeoramiento de los resultados de las enfermedades cardiovasculares, menos exámenes de detección de cáncer y deterioro de la salud mental, lo que lleva a un mayor exceso de mortalidad en los próximos años, con la clase trabajadora y los miembros más jóvenes de la sociedad con la carga más pesada, además de sostener la idea de que mantener a los estudiantes fuera de la escuela es una grave injusticia.
La inmunidad individual frente a un virus puede tenerse por distintos motivos: porque se ha pasado el virus y se ha generado alguna defensa específica que proteja frente a reinfecciones (pudiendo ser esta inmunidad a corto o más largo plazo), porque se haya generado inmunidad cruzada ante la exposición a otro patógeno distinto, o bien a través de una vacuna. No obstante, cuando muchas personas están inmunizadas dentro de una población contra un virus, este tendrá mucho más complicado expandirse, pudiendo llegar inlcuso a extinguirse. Basándose en esta última idea, algunos países buscaban la denominada inmunidad de rebaño. Esto implica no tomar medidas adicionales de protección, con la creencia de que se infectará mucha gente, hasta llegar a un porcentaje de infecciones en la población elevado, pero que frenaría los contagios porque quienes hubieran superado la enfermedad, gozarían de inmunidad, por lo que habría menos huéspedes potenciales para el virus hasta hacer muy difícil o imposible su contagio. Reino Unido hizo un amago inicial, pero posteriormente, el Primer Ministro Boris Johnson se desdijo y decretó medidas de confinamiento.

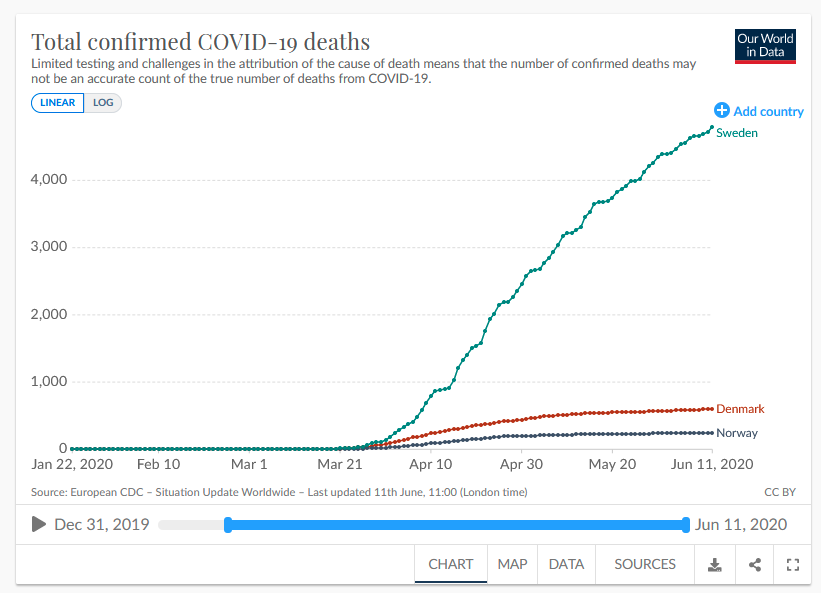
Suecia aplicó una estrategia blanda desde el principio (aunque los responsables políticos del país negaron que buscaran la inmunidad de rebaño), de forma que sus ciudadanos siguieron viviendo con relativa normalidad, sin confinamiento estricto ni cierre de comercios o escuelas. Comparando el número de fallecidos oficiales con los de los países vecinos, no parece que los resultados hayan resultado fructíferos de inicio, si bien a largo plazo, habría que valorar si los totales se igualan en esos países. Y es que sin intervención, el grueso de la pandemia se concentra en los meses iniciales, mientras que con intervención y medidas de confinamiento, los contagios se supone que serán más progresivos, pero la pandemia duraría más meses (ver noticia). Sin embargo, pese a no haber decretado confinamiento ni otras medidas estrictas, la proporción de fallecidos por habitante, no siendo de las más bajas del mundo precisamente, ha sido menor que en otros países que aplicaron otras medidas más estrictas (ver artículo). A finales de agosto, era el séptimo país con más fallecidos por habitantes, por detrás de Perú, Bélgica, Reino Unido, España, Chile e Italia, según datos oficiales (ver noticia). En otoño, la incidencia se disparó en Suecia, y algunos reconocieron ya en verano que no había sido buena estrategia la llevada hasta entonces (ver noticia). Para finales de año, la situación en Suecia seguía empeorando, llegando la ocupación de UCIs en Estocolmo al 99% (ver artículo). Y en marzo de 2021, se supo que el principal epidemiólogo sueco que defendía la inmunidad de rebaño habría estado omitiendo deliberadamente datos sobre brotes escolares y exceso de muertes infantiles (ver artículo).

Las críticas crecientes a la inmunidad de rebaño se consolidaron en una declaración firmada por científicos, médicos e investigadores de todo el mundo, llamada John Snow Memorandum, en la que se reúnen los principales consensos de la comunidad científica sobre el virus y la enfermedad. El objetivo de esta declaración es exigir más y mejores acciones a los gobiernos de todo el mundo, al mismo tiempo que se rechaza frontalmente la inmunidad de rebaño, ya que, según el documento, "cualquier estrategia de manejo de la pandemia que dependa de la inmunidad por infecciones naturales de covid-19 es errónea. La transmisión sin control en personas jóvenes arriesga a toda la población a un nivel significativo de morbilidad y mortalidad. Además del costo humano, esto impactaría a la fuerza de trabajo y abrumaría la capacidad de los sistemas de salud de brindar cuidados”.

También hay científicos que cuestionan hasta dónde se podría expandir el virus. Algunas estimaciones sugieren que a fecha de noviembre, menos del 5% de la población mundial habría estado ya expuesta al virus, y que, tomando como referencia infecciones pasadas, un 65% de la población no se infectó de la llamada "gripe española", o un 85% no se infectó de la gripe A, por lo que se llega a pensar que en torno a un 80% podría no llegar a verse contagiado por el SARS-CoV-2, aunque habrá que ver cómo evoluciona la pandemia.
Ahora bien, no habiendo vacuna aún disponible, la clave es... ¿qué proporciona inmunidad?. Desde el principio se ha hablado de un tipo de anticuerpos, las inmunoglobulinas de tipo IgG, que otorgarían inmunidad frente al virus y que se empiezan a desarrollar una vez se está empezando a superar la enfermedad. Aunque antes se generan otro tipo de inmunoglobulinas, de tipo IgM, que son las que empiezan a combatir el virus cuando se contrae, y después van desapareciendo progresivamente al mismo tiempo que empiezan a crearse las IgG. Todo esto combinado con la PCR, podía dar una idea de la evolución de la enfermedad, como muestra el siguiente cuadro, muy extendido durante los primeros meses de pandemia, pero que, como se detalla más adelante, sería matizable y no sería del todo exacto:

Fuente: Clínica CEMTRO
No obstante, hay estudios que indican que las IgG desarrolladas tienen una duración de dos o tres meses (ver artículo) o puede que de hasta seis meses (ver estudio), por lo que estas células no confieren una inmunidad permanente, lo que hace que no tengan sentido los certificados de inmunidad que se han llegado a proponer. Del mismo modo, una de las conclusiones de la tercera fase del estudio de seroprevalencia realizada por el Instituto de la Salud Carlos III, es que se observó seronegativización (ausencia de IgG detectables en personas que previamente los habían tenido). En concreto, el 7,1% los perdieron de la fase 1 a la fase 2, y el 14% aproximadamente desde la fase 1 (mayo) a la fase 3 (julio), siendo más frecuente en personas asintomáticas y menos frecuente en personas con PCR positiva o con anosmia o ageusia (ver artículo). Otro estudio encontró que había niveles altos de otro tipo de anticuerpos, los IgA, después de 50/60 días del inicio de síntomas, y que los niveles de IgG permanecían elevados, con solo un leve retroceso, hasta 120 días después del inicio de síntomas (ver estudio). En diciembre, un estudio realizado sobre sanitarios, concluyó que los que se habían infectado y tenían anticuerpos IgG, tenían una reducción sustancial de riesgo de reinfección en los siguientes seis meses (ver estudio).

Fuente: AMF
Otro estudio publicado por el CDC señaló que entre 156 sanitarios de primera línea que tuvieron resultado positivo en la prueba de anticuerpos en primavera, se observó que el 94% de ellos experimentó una disminución de los mismos aproximadamente 60 días después, y el 28% quedó por debajo del umbral de positividad, es decir, seronegativizaron el resultado (ver estudio).
Otro estudio publicado el 29 de octubre señalaba que habría dos perfiles en pacientes sintomáticos con respecto a la evolución de sus anticuerpos; un perfil de pacientes que perdería progresivamente anticuerpos con el tiempo, y otro grupo de personas que mantendrían, o incluso aumentarían, esos anticuerpos. Se observó también que había casos en los que los anticuerpos eran indetectables y otros en los que por el contrario habían desarrollado una respuesta robusta. De hecho, en la mayoría de los casos, se encontró que descendían los niveles de anticuerpos IgG (el anticuerpo específico IgG Anti-N en un 88% de los casos, el anticuerpo IgG anti-S en un 72% y el IgG anti-RBD en un 74%). Sin embargo, en algunos casos ocurría lo contrario, y al parecer, estaría relacionado con aquellas personas en los que los síntomas fueron menos persistentes, y también presentarían mayor cantidad de linfocitos T CD4+ (ver estudio).
También se ha observado que hay gente que ha superado la enfermedad (confirmada por PCR), pero no desarrollan anticuerpos, y aún así, podrían estar protegidos (ver noticia). La clave pueden ser otras células, llamadas linfocitos T de memoria, que no se detectan en las pruebas de anticuerpos que se están realizando, pues buscan anticuerpos de tipo IgM e IgG.
Existen estudios que sugieren la posibilidad de que personas que han pasado un resfriado provocado por otros tipos de coronavirus podrían tener cierta protección contra el SARS-CoV-2. Así lo expusieron investigadores del Instituto de Inmunología de La Jolla, California (ver noticia). Los científicos examinaron la respuesta de linfocitos T de memoria, unas células que genera el organismo como defensa a una infección previa, y que pueden tener una duración media de varios años, en muestras de sangre recogidas entre 2015 y 2018 (antes de la aparición del nuevo coronavirus). Muchos individuos mostraron que sus linfocitos T de memoria reaccionaban frente al SARS-CoV-2, pese a no haber estado expuestos a este virus pues las muestras son anteriores a él. Y era bastante seguro que casi todos habían sufrido al menos tres de los cuatro coronavirus menos graves (los que no causan ni el SARS, ni el MERS, ni la COVID-19). Esto explicaría la reactividad cruzada que se observó. El 29 de julio, la revista Nature publicó un estudio según el cual, el 35% de las personas observadas tenían linfocitos T de memoria contra el SARS-CoV-2, y no habían pasado la enfermedad ni habían desarrollado IgG específicas contra este coronavirus (ver artículo), y otro estudio posterior, también publicado en Nature, veía a confirmar esta hipótesis (ver estudio). Otro estudio publicado en noviembre señalaba que estos cuatro coronavirus responsables de "resfriados comunes" compartían una importante secuencia con el SARS-CoV-2., y encontró que, los individuos que habían sido infectados previamente con un eCoV mostraron una enfermedad menos grave por COVID-19, lo que sugiere que la respuesta inmune preexistente contra los cuatro coronavirus endémicos del resfriado puede mitigar las manifestaciones de la infección por SARS-CoV-2 (ver estudio).
Esto supondría que habría individuos por así decirlo, más protegidos (no necesariamente inmunes) al nuevo coronavirus, de forma que cuando entrara en su organismo, el sistema inmunológico comenzaría a emitir una respuesta inmediata contra él. Es decir, no se podría considerar inmunidad en sí, porque podrían contagiarse, pero su sistema inmunológico respondería de manera temprana y eficaz, evitando un agravamiento de la enfermedad. Además, otro estudio publicado en noviembre en Science vendría a confirmar una inmunidad humoral preexistente, pues en personas que no habían sufrido una infección, se detectaron anticuerpos de tipo IgG reactivos a la subunidad 2 de la proteína espiga del SARS-CoV-2, sobre todo en niños y adolescentes, y además, cuando se produce la infección por SARS-CoV-2, se producen IgG reactivos contra ambas subunidades de la proteína espiga, además de anticuerpos IgM e IgA (ver estudio).
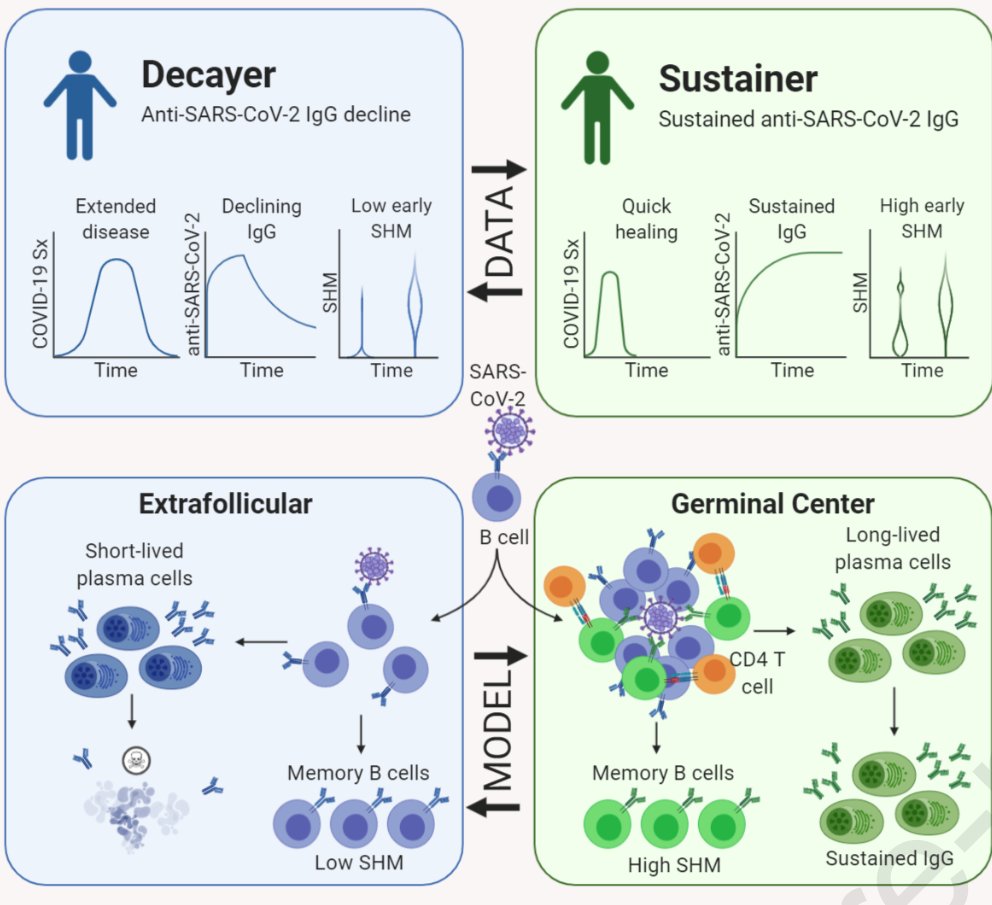
Del mismo modo, cabría suponer que personas que han pasado la COVID-19, podrían tener cierta inmunidad, aún no siéndoles detectados anticuerpos IgG, al haber generado su organismo linfocitos T de memoria específicos contra esta enfermedad. En este sentido, cabe recalcar un estudio que concluyó que las células T específicas de SARS-CoV-2 fueron detectables en familiares e individuos con anticuerpos seronegativos con antecedentes de COVID-19 asintomático o leve, y que el SARS-CoV-2 provoca respuestas robustas de células T de memoria similares a las observadas en el contexto de vacunas exitosas, lo que sugiere que la exposición natural o la infección pueden prevenir episodios recurrentes de COVID-19 grave también en individuos seronegativos. (ver artículo). En noviembre, un estudio sugería que la inmunidad celular mediada por linfocitos T CD4+ se mantendría como mínimo unos 6 meses tras la infección, siendo más potente en pacientes que manifestaron síntomas (ver estudio). Otro estudio también apuntaba que, aun cuando los niveles de anticuerpos (Ig) disminuyen, las células B de memoria de larga duración permanecerían para mediar en la rápida producción de anticuerpos, pues la infección por SARS-CoV-2 fortalecería la protección a través de anticuerpos reactivos (Ig) y la formación de estas células B de memoria (ver estudio). Por tanto, la ausencia de anticuerpos específicos contra el SARS-CoV-2 (Igs) no significa necesariamente una ausencia de memoria inmune, sino que pueden contribuir a ella las células B y T de memoria, como también se discute en un artículo publicado en la revista Nature (ver artículo).
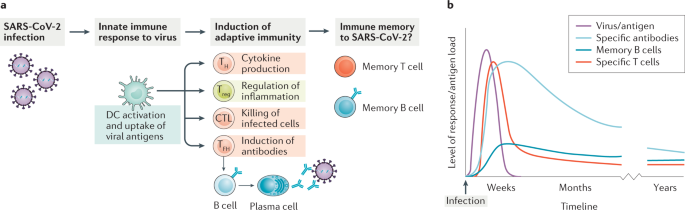
Fuente: Nature
Por todo lo anterior, la creación de certificados de inmunidad o cartillas COVID, como los propuestos en la comunidad de Madrid en julio (ver noticia), no parece una buena idea, y no está avalado ni por los científicos ni por la OMS. En base a las pruebas actuales, la PCR y la prueba serológica, inicialmente se pensaba que una persona con PCR negativa, y detección de IgM e IgG negativos, no habría pasado la enfermedad y no estaría contagiado. Pero en realidad, una persona con PCR negativa y niveles de IgM o IgG negativos, podría estar en las siguientes situaciones:
- No ha pasado la enfermedad y no está contagiado
- Es un contagio muy reciente (no detectable por PCR y sin desarrollar anticuerpos)
- Ha superado la enfermedad en el pasado y no ha desarrollado anticuerpos IgG e IgM (y podría tener inmunidad o no por linfocitos de memoria generados contra el SARS-CoV-2)
- Ha superado la enfermedad en el pasado y, aunque desarrolló anticuerpos IgG e IgM, los ha perdido al cabo de varios meses (y podría tener inmunidad o no por linfocitos de memoria generados contra el SARS-CoV-2)
- No ha pasado la enfermedad y podría tener cierta protección al tener linfocitos de memoria generado contra otros coronavirus
Estas posibilidades (y eso asumiendo que no hay fallo en las pruebas, pues no son infalibles), hacen inviable un carnet de inmunidad, pues se podría estar etiquetando como no inmune a alguien que podría serlo por tener linfocitos de memoria, o peor aún, se etiquetaría a alguien como inmune sin saber si hay posibilidad de reinfección. De hecho, la Sociedad Española de Inmunología (SEI), ha propuesto, a raíz del estudio ENE-COVID realizado por el ISCIII, que se realice un estudio de células T de memoria en primer lugar a aquellas personas que negativizaron el positivo de anticuerpos (pues desde la primera ronda del estudio de seroprevalencia en España hasta la ronda final, se detectó que un 14% habían seronegativizado anticuerpos IgG), así como a los pacientes con PCR positiva previa que no desarrollaron anticuerpos (ver noticia).
Para que existiera inmunidad de rebaño en algún momento, habría que asegurar además que no es posible una reinfección. A día de hoy, las certezas sobre la posibilidad de una segunda infección es otro de los enigmas que quedan por resolver, y es una cuestión fundamental para determinar si en un futuro podría haber inmunidad de rebaño. Si se echa un vistazo a cómo actúan los otros coronavirus, los cuatro primeros descubiertos, menos graves que los causantes del SARS, el MERS o la COVID-19, regresan año tras año y sí tienen capacidad de reinfectar a las mismas personas, de forma que los anticuerpos contra esos coronavirus aumentan para después ir desapareciendo. ¿Podría seguir el SARS-CoV-2 este mismo patrón? No es descartable según algunos investigadores (ver noticia).
Hasta el mes de agosto, hubo noticias sobre posibles casos de reinfección en China (ver noticia), pero, en algunos casos, las sospechas puntuales de reinfección podrían no obstante achacarse a falsos negativos en PCRs intermedias o incluso a positivos que se deban a restos de la presencia de virus, pero ya sin capacidad infecciosa (ver artículo). También en agosto, se publicó un pequeño estudio con conclusiones esperanzadoras, sobre un brote de SARS-CoV-2 en un buque pesquero asociado, en el que se hizo un seguimiento a través pruebas de PCR a 120 de las 122 personas a bordo, antes de partir y al regreso del mismo. Un total de 104 personas dieron positivo en algún momento, por lo que la tasa de ataque del virus fue superior al 85%. Se dio la circunstancia de que solo tres miembros de la tripulación habían sido seropositivos antes de la salida del barco, y además, tenían anticuerpos neutralizantes IgG, y ninguno de ellos mostró evidencia de infección viral ni síntoma alguno, lo que sugiere que la existencia de esos anticuerpos protege de manera efectiva contra una posible reinfección (ver estudio).
Pero apenas unos días más tarde, el 24 de agosto, se publicó otro estudio preliminar (no revisado), que confirmaría el primer caso de reinfección documentado, sobre un ciudadano de Hong-Kong que se reinfectó en España con otra cepa del virus distinta a la de la primera infección (pues se lograron secuenciar los genomas de ambas infecciones en su caso). Se observó que en la segunda infección no desarrolló la enfermedad, siendo asintomático, y mostrando una mejor respuesta de su sistema inmune, pues la respuesta humoral fue mayor, generando anticuerpos detectables después de la reinfección. Sin embargo, aunque no se enfermara, segundas reinfecciones sí que serían un problema, pues esas personas que las sufran podrían ser de nuevo potenciales contagiadores (ver noticia). En el caso concreto de esta primera reinfección documentada, hay expertos que tienen sus dudas; se habla de una primera infección con síntomas confirmada por PCR positiva el 16 de marzo, pero no desarrollando anticuerpos protectores de tipo IgG. Más tarde, se confirmaría una reinfección el 15 de agosto con PCR, pero a diferencia de lo que ocurrió en la primera, sí desarrolló IgG días más tarde (ver estudio). Es por ello por lo que, aunque la secuenciación indica la presencia de dos cepas virales distintas, algunos expertos sugieren que el positivo de marzo podría ser falso.
Durante esa semana de agosto, se documentaron más casos. El 25 de agosto se avisó de casos similares en Bélgica y Países Bajos (ver noticia). En el caso de Bélgica, la reinfección se habría producido a los 3 meses, determinándose que fue infectada por dos cepas distintas según los investigadores belgas. La reinfección en este caso fue leve y no necesitó hospitalización.
Y el 28 de agosto, se publicó otro estudio, que sugiere reinfección en un paciente de 25 años en Reno, Nevada, Estados Unidos (ver estudio). Este paciente se infectaría en marzo por primera vez, recuperándose tras un mes de aislamiento con síntomas variados (tos, dolor de garganta, diarrea, dolor de cabeza y nauseas), y siendo negativo en dos pruebas a partir de entonces. El paciente se encontró bien hasta finales de mayo, cuando volvió a ser positivo, tras 48 días, teniendo un cuadro más grave esta vez, pues necesitó hospitalización y oxigenación por hipoxia, además de mostrar dolor de cabeza, diarrea, mareos, fiebre, tos, disnea, mialgias y nauseas. Los genomas de los virus encontrados en ambos casos mostraron diferencias significativas. Posteriormente, en esta segunda infección, fue testado para ver si tenía anticuerpos IgG e IgM, resultando positivo en ambos casos.
Al finalizar agosto, en total, había documentados hasta 8 casos de posible reinfección, de los cuales 6 se habían recuperado y no había habido fallecidos. Ya en septiembre en España se comenzaron a documentar casos de reinfección, encontrándose cuatro casos en Cataluña, tres de ellos presentando una reinfección de carácter leve y otro caso algo más grave (ver noticia). También se documentaron dos reinfecciones en la India, que fueron casos asintomáticos, pero con mayor carga viral en la reinfección que en la infección inicial (ver noticia).
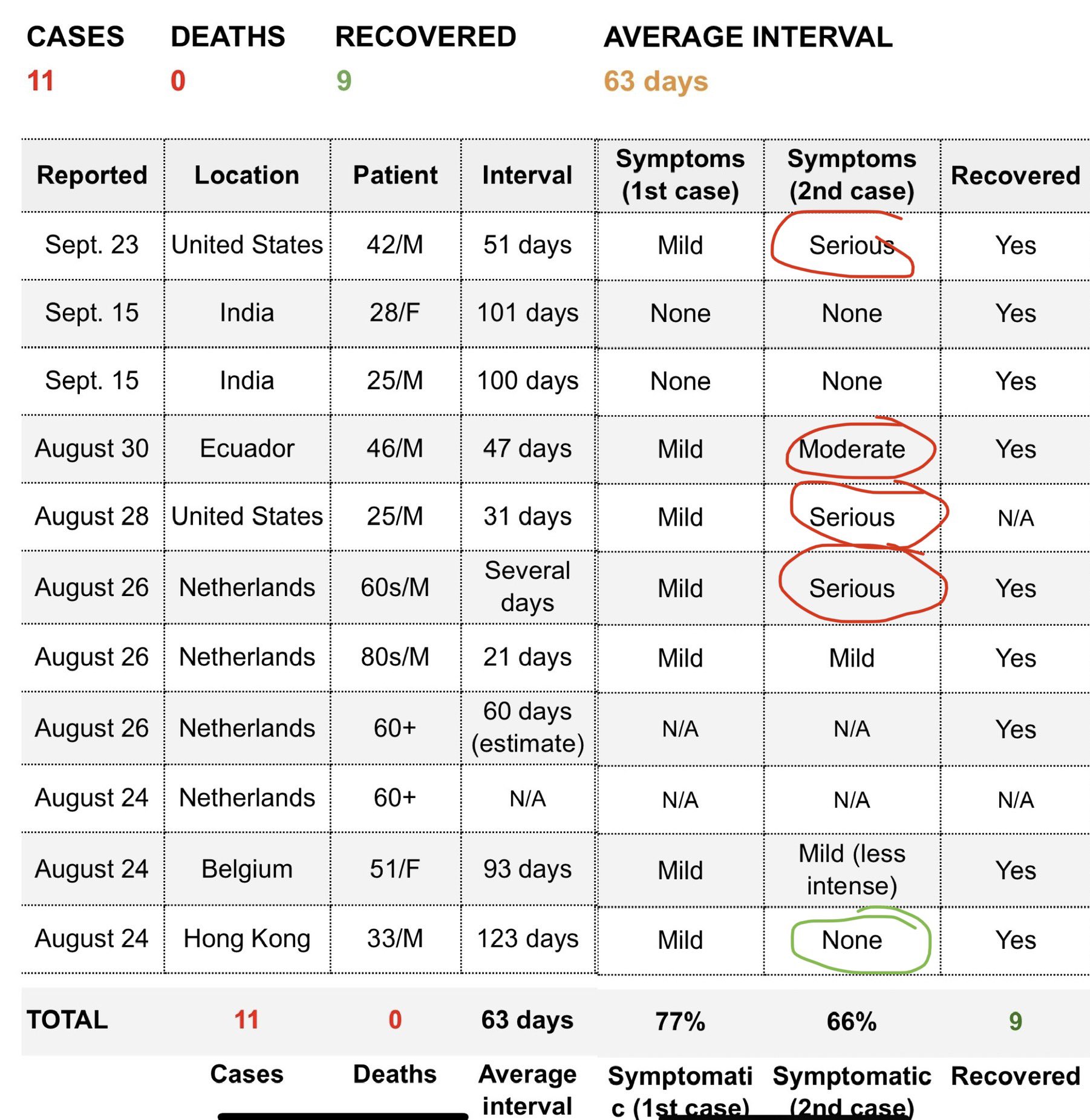
También se supo que un ciclista profesional, Fernando Gaviria, había sido contagiado dos veces por el virus, teniendo que abandonar el Giro de Italia en octubre, después de haber superado el virus en febrero (ver noticia). En diciembre de 2020 se publicó un estudio que hablaba de la reinfección sintomática por SARS-CoV-2 de un sanitario belga en un brote nosocomial, pese a tener una respuesta primaria de anticuerpos neutralizantes (ver estudio). El caso se confirmó ya que los genomas virales derivados del primer y segundo episodio eran distintos. La reinfección sintomática se produjo después de un intervalo de 185 días, a pesar del desarrollo de una respuesta inmune humoral eficaz después de la infección primaria sintomática. Sin embargo, el segundo episodio fue más leve y se caracterizó por un rápido aumento de la IgG sérica y de anticuerpos neutralizantes. Y también en diciembre un estudio hablaba de la posibilidad de reinfección en cuatro niños, siendo posiblemente estas reinfecciones más rápidas que en el caso de los adultos (ver estudio). En la siguiente tabla se puede ver la diferencia entre los síntomas en ambas infecciones en los cuatro casos.
El 21 de diciembre de 2020, Israel confirmaba la muerte de un paciente de 74 años que se había reinfectado meses después con una cepa distinta (ver noticia).
Desde diciembre de 2020, proliferaron las variantes de interés (VOI) y las variantes de preocupación (VOC). Algunos estudios sugieren que ciertas mutaciones de las VOC podrían escapar de los anticuerpos generados por vacunas o infección previa, si bien también es posible que el impacto sobre las células T generadas sea insignificante, como sugiere un preprint publicado en marzo de 2021 (ver estudio). No obstante, como se ha demostrado, sí se están dando casos de reinfección, por lo que esto no ocurriría en todos los casos.
Además, la entrada en juego de VOCs podría suponer cambios significativos en la inmunidad adquirida. Así, un estudio publicado en marzo de 2021, señalaba que (ver estudio):
- La variante africana (B.1.351) crea anticuerpos con reactividad cruzada contra otras variantes, y protegen contra la D614G (aunque los anticuerpos de esta tienen una eficacia reducida contra la B.1.351)
- También protegen contra la variante brasileña (P.1)
- La variante británica parece no producir anticuerpos muy eficaces contra la sudafricana.
- La variante sudafricana es resistente a anticuerpos dirigidos contra el RBD de clase I y II, pero los específicos de RBD de clase III y IV no se ven afectados.
En teoría, la respuesta inmune tras una infección previa o tras la vacunación, será más rápida y la carga viral será más baja en todo momento, como se puede observar en el siguiente gráfico, apareciendo los anticuerpos IgA e IgG al mismo tiempo que los IgM, y no más tarde como en una infección primaria (ver artículo).

Un estudio publicado en abril de 2021 concluía que la infección previa por SARS-CoV-2 se asoció con un 84% menos de riesgo de infección, con un efecto protector medio observado 7 meses después de la infección primaria. Este estudio mostraba por tanto que una infección previa con SARS-CoV-2 induciría una inmunidad eficaz a futuras infecciones en la mayoría de las personas (ver estudio).
- En Ginebra (Suiza) las personas que tenían IgG+ alcanzaron el 10'8% a finales de mayo.
- En Wuhan, un estudio realizado dos meses después del pico de infección sugería que la seroprevalencia podría estar en el intervalo del 2'6% al 5'4%.
- En Suecia, país en el que no se decretaron medidas estrictas ni confinamiento, la seroprevalencia estaba en un 7'3% a finales de abril.
Aún así, conocer la inmunidad real no es suficiente con estos estudios, puesto que habría que añadir aquellos que perdieron los anticuerpos y que podrían tener inmunidad por células de memoria, o los que podrían tener inmunidad por haber estado expuestos a otros coronavirus, que según los estudios comentados podrían suponer un 35% de la población (y si esto último fuese cierto, sí que se podría estar mucho más cerca de una inmunidad de rebaño). De hecho, a primeros de agosto, un estudio de Oxford sugería que algunos barrios de Madrid podrían estar cerca de la inmunidad de grupo, en base a la suposición de que un 35% de la población tendría inmunidad por exposición a otros coronavirus, y a que un importante porcentaje (más de un diez por ciento) de esos barrios ya habría pasado la enfermedad, por lo que se estaría cerca de alcanzar el porcentaje necesario para esta inmunidad (ver noticia). El epidemiólogo Jesús María Aranaz, del Hospital Universitario Ramón y Cajal de Madrid, estima que promover una inmunidad de rebaño sin establecer medidas estrictas de prevención (confinamiento, mascarillas, etc), al estilo sueco, podría tener un coste de 400.000 vidas en nuestro país (ver noticia).
Como dato curioso, un estudio publicado en enero de 2021, realizado en un hospital de Filadelfia, sugería que las mujeres embarazadas transferían anticuerpos de tipo IgG a los bebés a través de la placenta y el cordón umbilical en el 87% de los casos, independientemente de la gravedad de la enfermedad (ver estudio). Esto a su vez podría significar que los anticuerpos generados por una mujer vacunada podrían transferirse al bebé y conferirle protección.



 Factores de riesgo
Factores de riesgo Técnicas de detección
Técnicas de detección Tratamientos
Tratamientos Vacunas
Vacunas Carga viral
Carga viral Mutaciones
Mutaciones Letalidad y mortalidad
Letalidad y mortalidad Prevención: mascarillas
Prevención: mascarillas Prevención: Ventilación y filtración (HEPA)
Prevención: Ventilación y filtración (HEPA) Otras medidas de prevención
Otras medidas de prevención Impacto de la pandemia
Impacto de la pandemia Fin de la pandemia
Fin de la pandemia Prevención en centros educativos
Prevención en centros educativos Enlaces de interés
Enlaces de interés